Luiz de Assis Netto – Física USP
Um gerador de energia elétrica não cria nenhum elétron. Ele fornece energia aos elétrons para que eles possam percorrer o circuito. Quando um elétron percorre a bateria do polo positivo para o polo negativo ele ganha energia. Quando ele percorre o circuito, digamos, de um aquecedor elétrico, um motor, um computador, ou seja lá o que for, ele perde energia. Pense no elétron com sendo uma bola de basquetebol que um jogador manda para cima. Quando o jogador lança a bola para cima, ele fornece energia à bola. À medida que a bola sobe, ela vai perdendo energia cinética devido ao campo gravitacional da Terra, que a atrai para baixo, até que essa energia cinética se reduz a zero, quando a bola atinge a altura máxima; ela então começa a cair. Se o jogador então recolhe a bola e a manda para cima de novo, o ciclo se repete.
No interior da bateria, o elétron recebe energia devido a uma reação química exergônica (que liberta energia); no circuito externo, esse mesmo elétron perde energia na forma de luz, som, calor, movimento, ou seja lá o que for que o circuito do aparelho foi construído para produzir. O elétron retorna então à bateria, onde ele recebe energia de novo, e o ciclo recomeça.
Nenhum elétron é criado no processo. Os elétrons já estão na matéria. Os elétrons fazem parte da matéria.
Numa bateria de 1,5 volts, cada elétron no interior da bateria recebe uma energia de 1,5 elétron-volts.
Numa bateria química, o que ocorre é uma reação de oxi-redução. O que é uma reação de oxi-redução? É uma reação na qual um átomo perde elétrons, enquanto outro ganha. A gente diz que o átomo que perde elétrons é oxidado, enquanto que o átomo que ganha elétrons é reduzido. Só que no caso da bateria (pilha), essa reação de oxi-redução se dá através de um circuito externo. O átomo que cede um ou mais elétrons está no polo negativo da bateria; o átomo que recebe um ou mais elétrons está do outro lado, no polo positivo.
Por exemplo, uma bateria química muito fácil de construir em laboratório é esta:
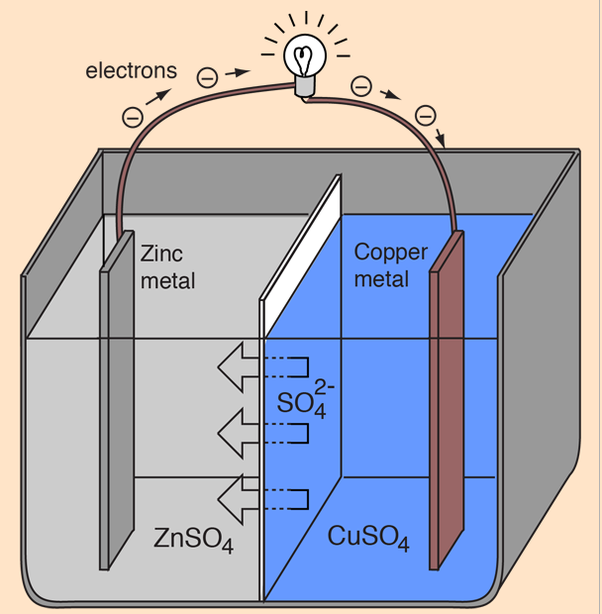
No lado esquerdo, temos uma solução aquosa de sulfato de zinco (1 mol/litro) na qual está mergulhada uma placa de zinco metálico; do outro lado temos uma placa de cobre metálico mergulhada numa solução aquosa de sulfato de cobre (1 mol/litro). As duas soluções estão separadas por uma membrana porosa.
Na reação de oxi-redução que ocorre nesta célula, o zinco é oxidado e o cobre é reduzido:
Zn(metálico) + Cu++ → Cu(metálico) + Zn++
Ou seja: o zinco metálico da placa da esquerda perde dois elétrons por átomo, enquanto o cobre em solução do lado direito (Cu++) recebe dois elétrons e é reduzido a cobre metálico. À medida que a reação se processa, a placa de zinco vai se dissolvendo, enquanto que a placa de cobre vai aumentando de tamanho, pois o cobre em solução vai se convertendo em cobre metálico, que se deposita sobre a placa da direita. A reação pára quando todo o zinco metálico tiver sido consumido. Uma célula como esta produz uma diferença de potencial de 1,1 volts, aproximadamente.

Alessandro Volta mostra sua nova invenção, a pilha elétrica, a Napoleão Bonaparte em 1800. A palavra “volt” vem do nome dele. Pode-se dizer que nesse momento teve início a era tecnológica moderna.
A invenção da bateria ou pilha por Alessandro Volta na virada do século XIX permitiu pela primeira vez produzir uma corrente elétrica que durasse mais do que uma fração de segundo, como ocorre habitualmente com a descarga elétrica entre dois corpos carregados.
![]()


